La agencia federal para los medicamentos en EE.UU. emitió una orden que permite que se produzca el remdesivir de manera emergente, para combatir la COVID-19, que ha cobrado la vida de más de 237.000 personas en el mundo y más de 64.000 en Estados Unidos.WASHINGTON —
La Agencia de Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) autorizó este viernes el uso de emergencia del Remdesivir para tratar las afecciones por la COVID-19.
En un comunicado la FDA dijo que “si bien se conoce información limitada sobre la seguridad y la eficacia del uso de Remdesivir para tratar a las personas en el hospital con COVID-19, se demostró en un ensayo clínico que el fármaco en investigación acorta el tiempo de recuperación en algunos pacientes”.
El organismo regulador en EE.UU. “determinó que es razonable creer que el Remdesivir puede ser eficaz en el tratamiento de COVID-19”.
La autorización de la agencia estadounidense para que la compañía farmacéutica Gilead Inc produzca el medicamento, llega dos días después de que los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) dieran a conocer que el uso de este fármaco ha rendido frutos.
“La cooperación fluida entre el Gobierno y la industria privada bajo el enfoque del presidente (…) está brindando opciones de tratamiento a los pacientes en un tiempo récord», dijo recientemente Alex Azar, jefe del Departamento de Salud y Servicios Sociales de Estados Unidos.
Este mismo viernes el presidente Donald Trump desveló la medida durante una comparecencia informal ante la prensa la prensa.
«Me complace anunciar que Gilead tiene ahora una exención de emergencia de la FDA para el Remdesivir. Sabéis lo que eso supone, porque ha sido un tema candente también en los periódicos y en los medios desde hace un tiempo», declaró el mandatario.
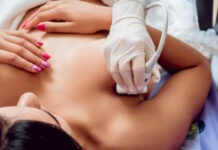
La autorización de la FDA permitirá que el medicamento contra la COVID-19 se distribuya en EE.UU. y se administre por vía intravenosa por proveedores de atención médica a enfermos con síntomas graves.
La entidad de medicamentos estadounidense define con este padecimiento a “pacientes con niveles bajos de oxígeno en la sangre o que necesitan terapia de oxígeno o soporte respiratorio más intensivo, como un ventilador mecánico”.
«Hay un enorme interés entre todas las partes para identificar y armarnos con medicamentos para combatir el COVID-19, y a través de nuestro Programa de Aceleración del Tratamiento de Coronavirus, la FDA está trabajando las 24 horas y utilizando todas las herramientas a nuestra disposición para acelerar estos esfuerzos”, explicó el comisionado de la FDA, Stephen M. Hahn, en el comunicado.
El jueves el doctor Anthony Fauci, la máxima autoridad científica del equipo designado por la Casa Blanca para gestionar la pandemia, apuntó en la cadena NBC que el medicamento no es “la respuesta definitiva” para detener la pandemia, sino “un importante primer paso” para encontrar tratamientos efectivos, que podrían tener un fuerte efecto en controlar el brote.
Efectos secundarios
Según el comunicado, el Gobierno de EE.UU. exige que «se pongan a disposición de los proveedores de atención médica y los pacientes” los detalles «sobre el uso de Remdesivir en el tratamiento de la COVID-19».
Las indicaciones federales solicitan que se agreguen a las instrucciones de dosificación, los posibles efectos secundarios y las interacciones con otros medicamentos.
Los posibles efectos secundarios de Remdesivir, señala la FDA incluyen: “Aumento de los niveles de enzimas hepáticas, que pueden ser un signo de inflamación o daño a las células del hígado; y reacciones relacionadas con la perfusión, que pueden incluir presión arterial baja, náuseas, vómitos, sudoración y escalofríos”.